Человек должен верить, что непонятное можно понять
Гёте И.В
Улучшение не возможно без изменений
Последние годы можно наблюдать нарастание количества изменений, которые вносятся в нормативные документы в области управления качеством. Если раньше какое-либо незначительное уточнение, планируемое к внесению в действующий стандарт, могло обсуждаться буквально годами, то сейчас темп нововведений просто стремительный. Это относится и к документам Международной организации по стандартизации (ИСО), и к правилами надлежащих практик в сфере обращения лекарственных средств. Можно предположить, что причиной этого является «взросление» самой науки управления качествам. Ведь эти стандарты очень «молоды»: правилам надлежащей производственной практики (GMP) около 50 лет, а первая версия стандартов в области обеспечения качества ИСО 9000 была опубликована в 1987 году. Теперь, после нескольких десятилетий, посвящённых первым шагам и наработке практического опыта (очень часто болезненного), по всей видимости, начинается этап переоценки и улучшения первоначально выработанных положений. Можно сказать, что специалистам по качеству очень повезло — в их области деятельности ещё не все проблемы решены и не все правильные ответы найдены. Это даёт возможность каждому из нас высказать свою точку зрения в области управления качеством и, может быть, в чём-то улучшить понимание всего этого процесса.
Фармацевтическая система качества — это…?
В последней редакции GMP EU глава 1 изменила название с «Обеспечение качества» на «Фармацевтическая система качества», так же она названа и в Правилах организации производства и контроля качества лекарственных средств (далее — Правила), утверждённых приказом Министерства промышленности и торговли РФ [1]. К сожалению, при этом в словарь терминов и определений упомянутых документов определения для «Фармацевтической системы качества» внесено не было. Оно есть только в «Рекомендациях по организации производства и контроля качества лекарственных средств» [2]: «Фармацевтическая Система Качества — система менеджмента качества для того, что бы направлять фармацевтическую компанию и управлять ею применительно к качеству». По-моему, сутевая часть этого определения может быть понята только самыми продвинутым специалистам в области управления качеством.
На сегодняшний момент часть текста главы 1 Правил надлежащей производственной практики представляет собой перечисление отдельных элементов, которые должны входить в фармацевтическую систему качества. Они идентифицированы в пункте 9.(1.4) и в таких разделах главы 1, как: «Организация производства и контроля качества лекарственных средств», «Контроль качества», «Обзор качества продукции» и «Управление рисками для качества. Но для того, что бы этот набор элементов можно было воспринимать как систему (в данном случае — фармацевтическую систему качества), недостаёт выстроенных отношений и связи отдельных элементов друг с другом, образующих единую целостность.
Поэтому в данной статье попробуем сами шаг за шагом выстроить элементы фармацевтической системы качества в единую, понятную, легко визуализируемую систему. Ведь только понимание общей конфигурации системы, набора составляющих ей элементов, их взаимосвязи, роли и ответственности персонала различного уровня позволит правильно выстроить фармацевтической системы качества и обеспечить её эффективное функционирование.
Как уже говорилось выше, в Рекомендациях по организации производства и контроля качества лекарственных средств фармацевтическая система качества названа системой менеджмента, а «система менеджмента» — это система управления, объектом которой являются люди, коллективы организации. Поэтому далее мы будем рассматривать фармацевтическую систему качества как один из вариантов системы управления.
Общие понятия, используемые в системе управления
Сначала предлагаю определиться в терминах, которые мы будем использовать. В настоящий момент в теории управления (науке о принципах и методах управления различными системами, процессами и объектами) различными авторами применяется сложный и не всегда однозначный набор определений. Для наших целей мы постараемся использовать самые элементарные необходимые термины и простые, понятные каждому формулировки.
Для «системы управления», это, пожалуй следующее определение: «система управления- это совокупность субъекта (того, кто управляет), объекта (того, чем управляют), воздействия субъекта на объект с целью движения к цели, заданной субъектом, и получения субъектом обратной связи о движении объекта.
Это сложное с первого взгляда определение очень легко запомнить, если посмотреть на его графическое изображение (рисунок 1).
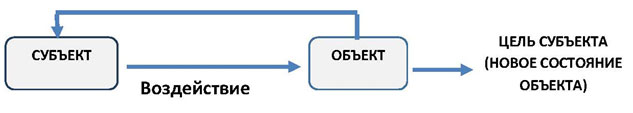
Рисунок 1. Схема системы управления
Согласно этой схеме происходит управление любыми системами: техническими, биологическими, человеческими. Стоит посмотреть вокруг и мы увидим бесчисленное множество систем управления: мать ведёт ребёнка в школу (субъект — мать, объект-ребёнок, цель — ребёнок в школе; токарь (субъект) точит болванку (объект), цель — получение заданной детали. И в каждом из этих примеров субъект воздействует на объект и наблюдает за движением объекта к цели.
Необходимо выделить одно из обязательных условий успешного управления: субъект должен обладать достаточным «рычагом власти» (полномочиями и ресурсами) для воздействия на объект.
Немного усложним ситуацию: если действий субъекта по «воздействию» на объект и «получению обратной связи» довольно много, то их можно объединить в совокупность, называемую системой связи (СС). Графически это представлено на рисунке 2.

Рисунок 2. Схема системы управления с выделением процессов управления
И таких систем управления тоже огромное множество: водитель управляет автомобилем, а технолог процессом через множество прямых действий на объект и обработку обратной связи, то есть через систему связи.
Нам необходимо ввести характеристику системы: по способу её взаимоотношений с окружающей средой. Закрытая система, как это ясно из названия — отграничена от окружающего мира, взаимодействие происходит только внутри системы между ее структурными компонентами.
В противоположность закрытой системе, открытая система функционирует благодаря взаимодействию с окружающим миром.
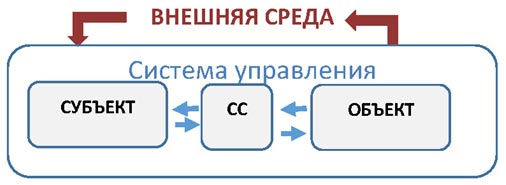
Рисунок 3. Схема открытой системы управления
И последнее необходимое нам понятие- декомпозиция системы управления. Если объект управления является сложной системой, то для простоты управления логично разделить (декомпозировать) его на несколько самостоятельных подсистем управления, в каждой из которой будет свой субъект и объект управления.
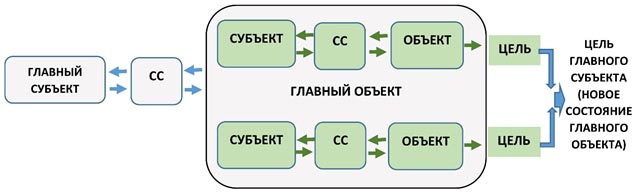
Рисунок 4. Схема декомпозиции системы управления
Главный субъект декомпозирует главный объект на более мелкие подсистемы управления, в которых есть свои субъекты и объекты, а так же системы связи. Главный субъект делегирует этим субъектам часть своих полномочий. Общая цель главной системы при этом может быть достигнута в том случае, если каждая подсистема сможет достичь своей цели. При этом окончательную ответственность за достижение главной цели несёт главный субъект. Это объяснение хорошо известного принципа «можно делегировать только полномочия, но не ответственность» с точки зрения теории управления. Для достижения общей цели главный субъект должен вырабатывать общую стратегию движения объекта, выделять необходимые ресурсы, идентифицировать подсистемы управления и согласовывать их действия, а так же определять полномочия соответствующих субъектов.
Этот принцип разделения большой системы на несколько подсистем управления положен в основу иерархической структуры большинства предприятий.
Визуализация фармацевтической системы качества
Теперь опять вернёмся к фармацевтической системе качества и проанализируем текст Правил надлежащей производственной практики, используя принципы, подходы и термины, применяемые в теории управления.
1. Цель
Сначала определим цель фармацевтической системы качества. Она чётко прописана в главе 1 (Принцип): «Производитель должен производить лекарственные средства так, что бы гарантировать их соответствие своему назначению, требованиям регистрационного досье или протоколу клинического исследования и исключить риск, связанный с неудовлетворительными качеством, безопасностью, эффективностью».
2. Субъект
Следующий шаг — определение субъекта, который должен двигать объект к достижению цели. Он тоже однозначно определён в главе 1 (Принцип) сразу после формулировки целей: «Ответственность за выполнение этих требований несёт руководство производителя» и в п.10. (1.5): «Руководство несёт ответственность за наличие эффективной фармацевтической системы качества, необходимых ресурсов». Далее показан «рычаг власти», которым должно использовать руководство: «…Руководство активно участвует в фармацевтической системе качества, что гарантирует поддержку и заинтересованность персонала на всех уровнях и во всех подразделениях производителя в функционировании фармацевтической системы качества». По-моему, приведённая формулировка «активно участвует» не полностью передаёт роль высшего руководства. «Участие», даже активное, часто понимается как совместно выполняемая с кем-либо деятельность. Более чётко роль высшего руководства сформулирована в Проекте Правил надлежащей производственной практики Евразийского экономического союза [3]: «п.1.5 Высшее руководство несёт основную ответственность за наличие эффективной фармацевтической системы качества, за то, что имеются необходимые ресурсы и что обязанности, ответственность и полномочия определены, доведены до сведения и выполняются, реализуются во всех подразделениях предприятия. Важна лидирующая роль руководства и его активное участие в фармацевтической системе качества.» В этом же проекте роль высшего руководств ещё раз подчеркнута в п.2.4: «Высшее руководство несёт основную ответственность за обеспечение эффективной системы управления качеством для достижения целей в области качества…».Итак, субъект фармацевтической системы качества определён — высшее руководство.
3. Объект
В тексте Правил есть чёткие указания о том, кто является объектом управления фармацевтической системы качества. В главе 1 (Принцип) определено, что достижение цели — выпуск безопасной, эффективной и качественной продукции, «требует надлежащего исполнения своих обязанностей персоналом различных подразделений на всех уровнях…». В Главе 2 (Персонал) об этом сказано более детально: «…производитель для решения всех задач, за которые он отвечает, имеет достаточное количество квалифицированного персонала».Определён и объект фармацевтической системы качества — персонал предприятия.
4. Декомпозиция
Необходимость декомпозиции фармацевтической системы качества на несколько подсистем управления очевидна, так как деятельность фармацевтического предприятия многогранна и требует профессиональных компетенций в различных областях: технологии, логистике, контроле качества, инфраструктуре и многих других. Для систематизации управления Правила надлежащей производственной практики требуют: «п. 26. (2.2) Производитель должен иметь чёткую организационную структуру. Должностные обязанности работников, занимающих ответственные должности, должны быть изложены в должностных инструкциях. Указанные работники должны обладать полномочиями, необходимыми для выполнения возложенных на них функций». При этом в тексте GMP (п.27. (2.3)) есть прямое указание о необходимости наличия только руководителя производства и руководителя контроля качества, которые отнесены к ответственному (ключевому) персоналу. Их обязанности, соответствующие задачам субъекта, управляющего своим объектом (в данном случае подразделением) изложены в п.30. (2.5), 31. (2.6) и 32. (2.7).Деятельности этих подсистем управления в GMP отведены глава 5 (Производство) и глава 6 (Контроль качества).
Учитывая сложность работы фармацевтического завода, в тексте Правил выделены требования по управлению ещё двумя подсистемами: глава 2 (Персонал) и глава 3 (Помещения и оборудования). В зависимости от размера предприятия, в его структуре может не быть отдела персонала или службы инфраструктуры, но действия по управлению этим подсистемами всё равно должны быть, то есть должны быть назначены ответственные лица (субъекты) и определены их полномочия.
В итоге мы получили следующую декомпозицию объекта в фармацевтической системе качества:
| Подсистема управления | Субъект | Объект управления |
|---|---|---|
| Производство (Глава 5) | Руководитель производства | Сотрудники производства |
| Контроль качества (Глава 6) | Руководитель подразделения контроля качества | Сотрудники подразделения контроля качества |
| Помещения и оборудование (глава 3) | Или отдельно назначенный руководитель или совмещающий с другой должностью | Сотрудники, работающие с объектами инфраструктуры |
| Персонал (глава 2) | Или отдельно назначенный руководитель или совмещающий с другой должностью | Сотрудники отдела персонала (если он есть) и все работники предприятия по общим вопросам управления персоналом |
5. Система связи
Напомню, что система связи- это совокупность воздействий субъекта на объект и принятия обратной связи о том, в каком состоянии находится объект. Нам надо определить, какие элементы GMP можно отнести к системе связи между высшим руководством (субъектом управления фармацевтической системы качества) и персоналом предприятия (объектом управления фармацевтической системы качества). Аналогичная система связи будет и в каждой подсистеме управления.Прежде всего к системе связи следует отнести выполнение положений главы 4 (Документация). В GMP об этом написано так: «п.92. Документация составляет неотъемлемую часть фармацевтической системы качества и является ключевым элементом организации производства и контроля качества продукции в соответствии с настоящими правилами». Легитимным способом передачи информации в GMP является её документирование. Регламентирующие и регистрирующие документы выполняют роль каналов, посредством которых осуществляется взаимодействие между субъектом и объектом в системе управления.
Очевидно, что в систему связи субъекта с объектом необходимо включить такой элемент фармацевтической системы качества, как самоинспекция (глава 9). В результате самоинспекции субъект должен получить объективную обратную связь о состоянии объекта и затем воздействовать на объект для устранения выявленных и потенциальных несоответствий. В Правилах это зафиксировано следующим образом: «п.273. Самоинспекция проводится с целью проверки выполнения производителем требований настоящих Правил и предложения необходимых корректирующих действий» и «п.9. (1.4) с) (xvii) имеется процедура проведения самоинспекции и (или) аудита качества, в соответствии с которой регулярно оцениваются эффективность и пригодность фармацевтической системы качества».
Аналогичная схема (получение субъектом информации — воздействие на объект) в соответствии в правилами должна реализоваться при управлении несоответствиями и корректирующими и предупреждающими действиями (п.9. (1.4) о) (xiv)), а так же при управлении изменениями (п.9. (1.4) м) (xi), н (xii)).
К элементам системы связи необходимо отнести так же требования п.9. (1.4) з) (viii)): «установлено и поддерживается постоянно контролируемое состояние путём разработки и использования эффективного мониторинга и контрольных систем в отношении эффективности процесса и качества лекарственного средства» (это получение обратной связи от объекта) и п. 9. (1.4) л) (xi)): «осуществляется постоянное улучшение посредством внедрения усовершенствований, основанных на актуальных знаниях процесса и продукции» (это воздействие субъекта на объект с целью продвижения его к цели).
Все эти элементы системы связи должны быть использованы для управления как в фармацевтической системы качества в целом, так и в её подсистемах: «производстве», «контроле качества», «персонале», «помещениях и оборудовании».
К элементам системы связи, которые применимы в основном для высшего руководства следует отнести раздел «Обзор качества продукции» (п.17. (1.10) -п.21) и периодические обзоры функционирования фармацевтической системы качества: «п.11. (1.6) Необходимо проводить периодические обзоры функционирования фармацевтической системы качества с вовлечением в этот процесс руководства для постоянного улучшения продукции, процессов и самой системы».
Так же как элемент системы связи можно рассматривать управление рисками (п.22. (1.12) — 23. (1.13), так как любые воздействия на объект должны оценены с точки зрения рисков. Итак, в качестве системы связи можно рассматривать совокупность следующих элементов фармацевтической системы качества:
- Документация (глава 4);
- Самоинспекция (глава 9);
- Управление несоответствиями (пункт в главе 1);
- Управление корректирующими и предупреждающими действиями (пункт в главе 1);
- Управление изменениями (пункты в главе 1);
- Непрерывные улучшения (пункт в главе 1);
- Обзор качества продукции (раздел главы 1);
- Обзор функционирования фармацевтической системы качества (раздел главы 1);
- Управление рисками (раздел главы 1).
6. Взаимодействие с внешней средой
К элементам фармацевтической системы качества, реализующим взаимодействие с внешней средой можно отнести:
- Деятельность, передаваемую для выполнения другой организации (аутсорсинг) (Глава 7);
- Претензии и отзыв продукции (Глава 8);
- Утверждение поставщиков/производителей (раздел в главе 5).
7. Компонуем набор элементов в фармацевтическую систему качества
В результате анализа текста Правил надлежащей производственной практики мы определили: субъект, объект (и его декомпозицию), систему связи и процессы взаимодействия с внешней средой- то есть все элементы, необходимые для визуализации фармацевтической системы качества как системы управления. Их взаимосвязь показана на рисунке 5.
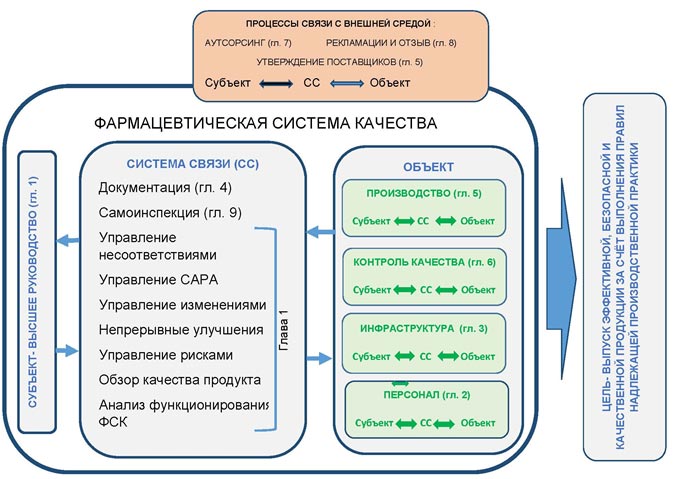
Рисунок 5. Визуализация Фармацевтической системы качества как системы управления
Итоги или для чего всё это было сделано?
Конечно, целью данной статьи не было получение какого-либо рисунка. Визуализация фармацевтической системы качества — это возможность простыми средствами изложить ожидания правил GMP по построению фармацевтической системы качества. Что же хотелось отобразить на этой схеме?
- Фармацевтическая система качества- это система управления, охватывающая все подразделения предприятия, чья деятельность может оказать влияние на эффективность, безопасность и качество продукции.
- Основную ответственность за наличие и эффективное функционирование фармацевтической системы качества несёт высшее руководство предприятия. Оно должно определить цель в области качества и активно применять рычаги воздействия и выделять ресурсы для достижения этой цели.
- Руководителю каждой подсистемы управления (как правило, руководителю подразделения) высшее руководство делегирует часть своих полномочий по управлению фармацевтической системы качества в данной подсистеме. При этом руководитель подразделения несёт ответственность перед высшим руководством за правильность своих действий и достижению целей своего подразделения в области качества.
- Достижение цели в области качества возможно лишь при усилии всего персонала предприятия (от высшего руководства до рядового сотрудника), который «знает положения настоящих Правил, относящиеся у его деятельности» (п.24)
- Для связи субъекта и объекта должна быть разработана и функционировать система связи, включающая документацию, самоинспекцию, управление несоответствиями, управление САРА, управление изменениями, непрерывное улучшение, управление рисками, анализ функционирования отдельных подсистем управления и фармацевтической системы качества в целом. Эта система воздействия на объект и получения от него обратной связи используется как высшим руководством при управлении всем предприятием, так и руководителями более низкого ранга в своих подсистемах управления.
- Фармацевтическая система качества должна активно взаимодействовать с внешней средой, особенно в части получения информации о качестве своей продукции.
И что ещё не сказано?
Конечно, в этой статье рассмотрены только основные моменты конфигурации и визуализации фармацевтической системы качества. Не проанализирована роль уполномоченного лица, не определено, кто должен выстраивать элементы, входящие в систему связи (и роль в этом директора по качеству и отдела обеспечения качества), не показана роль процессного подхода. Но эти темы требуют более глубокого освещения в отдельных статьях, написание которых уже запланировано.
Конечно, каждое из высказанных автором положений может быть оспорено, и кто-то имеет другую точку зрения и свою картину визуализации фармацевтической системы качества. Давайте обсуждать, спорить, двигаться вперёд вместе!
Осмоловская И.А.
Руководитель направления разработки фармацевтических систем качества.
ЛИТЕРАТУРА
- Приказ Министерства промышленности и торговли Российской Федерации от 14.06.2013 № 916 «Об утверждении Правил организации производства и контроля качества лекарственных средств».
- Приказ Министерства промышленности и торговли Российской Федерации от 12.12.2013 №1997 «Об утверждении Рекомендаций по организации производства и контроля качества лекарственных средств». (дата обращения 10.08.2015).
- Проект Правил надлежащей производственной практики Евразийского экономического союза.